Evolução Histórica
As primeiras iniciativas:
Robert Boyle: The Sceptical Chymist
Definições primitivas de elemento químico.
Guyton de Morveau: Encyclopedie Methodique
A primeira tentativa de uma publicação ampla, que por exposição e debate, servisse de referência para os químicos da época.
A publicação revolucionária
Lavoisier, Berthollet, Forcroy e Guyton de Morveau: Méthode de Nomeclature Chimique
A principal obra de nomenclatura química da história, pois propõe uma unificação de linguagem entre os químicos, de tal forma que os nomes alquímicos, pudessem ter uma raiz mais lógica e compreensível.
Esta obra, foi sem dúvida alguma, a ponta de lança da nomenclatura moderna !! Brilhante, maravilhosa !!
Observe os exemplos:
| Nome alquímico (antigo) | Nome proposto (atual) |
| Gás Silvestre Ácido Vitrolico Ác. Vitrolico Flogisticado Ác. Vitríolo Doce Espírito do Sal Galena Litargírio |
Gás carbônico Ác. Sulfúrico Ác. Sulfuroso Éter Dietílico Cloreto de hidrogênio Sulfureto de Chumbo Óxido de Chumbo |
O livro guia – A Primeira Reforma
Antoine Lavoisier: Traité Élémntaire de Chimie (1789)
Esta obra tornou-se o marco da química moderna. Nela veio se consolidar o uso da nomenclatura sistemática química, a queda da teoria flogística da combustão, e a lei da conservação da massa, pela medida precisa de uma balança.
Com esta publicação, Lavoisier deixa a França, e entre para história !!!
O revolucionário
John Berzelius : Essai Sur La Théorie Dês Proportions Définies Et Sur L`Influence Chimique De L`Electricité (1818)
Foi o gênio, que introduziu no mundo, o uso da simbologia química. Completando a reforma química da nomenclatura Inorgânica.
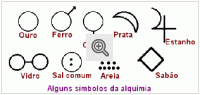
Abaixo ilustramos alguns dos estranhos símbolos e sinais enigmáticos que ainda eram usados no tempo de Lavoisier.
Berzelius argumentou que "os sinais químicos devem ser letras, para maior facilidade de anotação (...) Portanto, tomarei como símbolo químico a letra inicial do nome latino (ou comum) de cada elemento químico (...) ". Quando a primeira letra era comum a outro elemento, ele utilizava ambas as letras iniciais e a primeira seguinte que não era comum. Os novos símbolos são dados abaixo, para alguns elementos comuns:
| Elemento | Símbolo | Derivação |
| Carbono Cobre Cobalto Cálcio Cloro Cromo Ferro Potássio Nitrogênio Oxigênio Fósforo Enxofre Silício Estanho Zinco |
C Cu Co Ca Cl Cr Fe K N O P S Si Sn Zn |
nome comum Cuprum (latim) Cobaltum (latim) Calx (latim) nome comum Chrom (grego) Ferrum (latim) Kalium (latim) nome comum nome comum nome comum nome comum Sílex (latim) Stannum (latim) nome comum |
Berzelius usou estes símbolos para formar os símbolos dos compostos. O óxido de cobre, por exemplo, torna-se CuO — com o símbolo do metal precedendo o do não metal. Similarmente, o sulfureto de zinco torna-se ZnS. A terminação “eto” geralmente representa um composto consistindo de apenas dois elementos.
Os novos símbolos são também usados para indicar as proporções relativas dos elementos que entram em um composto. A menor parte de um elemento é chamada de “átomo”, e a menor parte de um composto é chamada de “molécula”. Portanto, uma molécula de CuO contém um átomo de cobre e um de oxigênio. A fórmula do dióxido de carbono é CO2, que nos diz que um átomo de carbono combinou-se com dois átomos de oxigênio. O prefixo “di-” em dióxido representa os dois átomos de oxigênio. A fórmula do monóxido de carbono, por outro lado, é CO. O “mono-” do monóxido de carbono indica a presença de apenas um átomo de oxigênio. Os dois gases, CO e CO2, são inteiramente diferentes, embora contenham os mesmos elementos. O primeiro é um veneno mortal, e o último dá à soda e ao champanhe sua agradável efervescência.
Os nomes e os símbolos reformados não foram usados extensivamente até boa parte do século dezenove. Eles nos ajudarão, entretanto, a compreender as grandes descobertas do século dezoito, as quais teremos oportunidade de comentar.
Ainda hoje, no linguajar popular, restam vestígios de nomes que resistiram aos "Primeiros Passos":
| Nome popular | Nome científico |
| acetileno | etino |
| anilina | fenilamina |
| azinavre | sulfeto de mercúrio |
| bauxita | óxido de alumínio |
| blenda | sulfato de zinco |
| bórax | borato de sódio |
| cal extinta | hidróxido de cálcio |
| cal viva | óxido de cálcio |
| carbureto | carbureto de cálcio |
| cianureto | cianeto de potássio |
| gesso | sulfato de cálcio |
| glicerina | 1,2,3 propanotriol |
| grisú | metano |
| magnésia | óxido de magnésio |
| zarcão | tetróxido de trichumbo |
| potassa cáustica | hidróxido de potássio |
| propana | propano |
| sal amargo | sulfato de sódio |
| sal de cozinha | cloreto de sódio |
| sal de estanho | cloreto estanoso diidratado |
| soda | carbonato de sódio |
| soda cáustica | hidróxido de sódio |
| ureia | carbamida |
Atualmente
General
Principles of Chemical Nomenclature: a Guide to IUPAC Recommendations
Leigh, G.J.; Favre, H.A. and Metanomski, W.V.
Blackwell Science, 1998 [ISBN 0-86542-6856]
The Red Book
Nomenclature of Inorganic Chemistry (recommendations 1990)
Leigh, G.J.
Blackwell Science, 1990 [ISBN 0-63202-4941]
Nomenclature of Inorganic Chemistry II. Recommendations 2000
McCleverty, J.A. and Connelly, N.G.
The Royal Society of Chemistry, 2001 [ISBN 0854044876]
Nomenclature of Inorganic Chemistry - IUPAC Recommendations 2005
Connelly, N.G, Damhus, T., Hartshorn, R.M., and Hutton, A.T.
The Royal Society of Chemistry, 2005 [ISBN 0 85404 438 8]
Hungarian edition, prepared by P. Fodor-Csányi
Akadémiai Kiadó, Budapest, 2003
| IUPAC (Sistemático) |
Tradicional (Usual, trivial ou semi-sistemático) |
| O2 – Dioxigênio | Oxigênio |
| O3 – Cadeias Catena – Trioxigênio | Ozônio |
| HNO2 – Ác. Dioxonitrico | Ác. Nitroso |
| HNO3 - Ác. Trioxonitrico | Ác. Nítrico |
| H3PO4 – Ác. Tetraoxo Fosfórico | Ác. Fosfórico |
| H3BO3 - Ác. Trioxobórico | Ác. Bórico |
| H2CO3 – Ác. Trioxocarbônico | Ác. Carbônico |
| H2SO3 – Ác. Trioxossulfurico | Ác. Sulfuroso |
| H2SO4 – Ác. Tetraoxossulfurico | Ác. Sulfuroso |
| HCLO4 – Ác. Tetraoxoclorico | Ác. Perclórico |
| HCLO3– Ác. Trioxoclorico | Ác. Clórico |
| HCLO2 – Ác. Dioxoclórico | Ác. Cloroso |
| HCLO – Ác. Monoclorico | Ác. Hipocloroso |
| HMnO4 – Ác. Tetraoxomangânico (-1) | Ác. Permangânico |
| H2MnO4 – Ác. Tetraoxomangânico (2-) | Ác. Mangânico |
| Na2SO4 – Tetraoxossulfato de sódio | Sulfato de sódio |
| K3PO4– Tetraoxofosfato de Potássio | Fosfato de Potássio |
| CH4 – Carbano | Metano |
| H2O – Oxidano | Água |
| NH3 – Nitrano ou Azano | Amônia ou gás amoníaco |
Treino Geral
Apenas observando a tabela abaixo, sem ter que memorizar (decorar) cada elemento, mostre como se faz a fórmula química correta dos compostos inorgânicos
International Union of Pure and Applied Chemistry
Inorganic Chemistry Division
Sais
Sulfato de ferro II deca-hidratado
Hipoiodito de cálcio
Cloreto de Ouro III
Nitrato de potássio
Perclorato da bário
Nitrito duplo de sódio e alumínio
Bissulfito de potássio (monohidrogeno-sulfito de potássio)
Tiossulfato de sódio e potássio
Carbeto de alumínio
Cromato de Lítio
Ácidos
Ác. Meta-Fosfórico
Ác. Orto-Bórico
Ác. Tio-Carbônico
Ác. Nitroso
Ác. Perclórico
Ác. Iodoso
Ác. Tiossulfuroso
Ác. Hipobromoso
Ác. Pirofosforoso
Hidretos e Hidróxidos
Hidreto de Cádmio
Hidreto de Magnésio
Hidreto de carbono
Hidróxido de Platina IV
Hidróxido de sódio
Hidróxido de alumínio
Hidróxido de ouro III
Óxidos
Óxido de Sódio
Óxido de Alumínio
Óxido de Cálcio
Óxido de Cobre II
Óxido de Ferro III
Pentóxido de dinitrogênio
Trióxido de enxofre
Monóxido de carbono